1) Ébullition de l’eau pure dans des conditions normales de pression
L’eau étudiée est de l’eau pure : on utilise donc de l’eau distillée qui ne contient plus aucun minéral.
Pour provoquer l’ébullition d’une eau, il suffit de chauffer suffisamment cette dernière.
La température de l’eau est mesurée avec un thermomètre tandis que celle-ci est chauffée jusqu’à ébullition.
La température est relevée toutes les minutes.
Lors d’une telle expérience, voici les résultats que l’on peut obtenir :
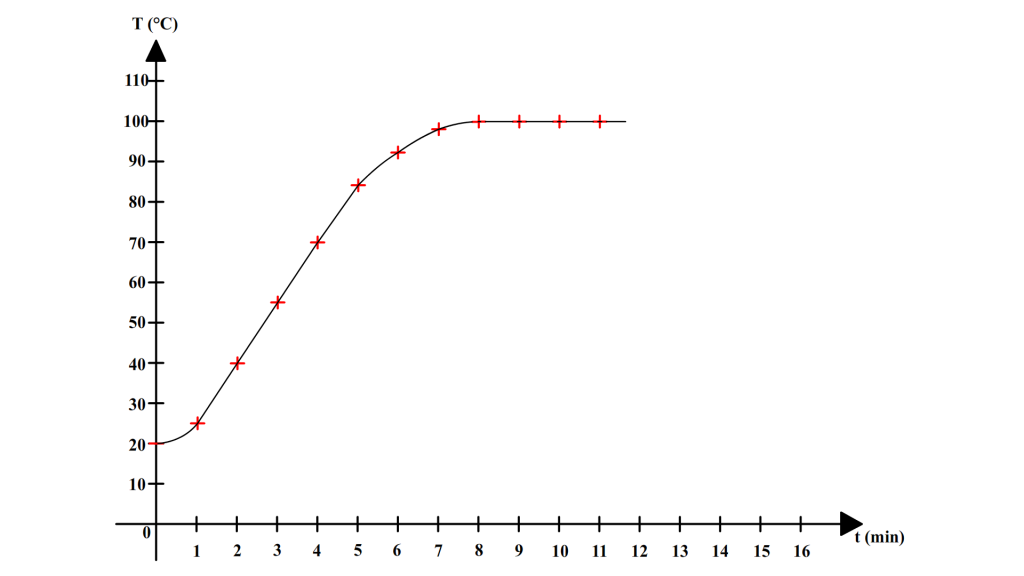
| Temps (min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Température (°C) | 20 | 25 | 40 | 55 | 70 | 84 | 92 | 98 | 100 | 100 | 100 | 100 |
Ces résultats peuvent êtres représentés par un graphique sur lequel on représente les variations de la température au cours du temps :
Interprétation
Avant l’ébullition la température ne cesse d’augmenter et l’eau reste liquide mais lorsque l’eau commence à bouillir, alors elle garde la même température (100°C).
Conclusion
L’eau pure bout à une température constante de 100 °C.
2) Ébullition de l’eau pure sous faible pression
La pression correspond à la poussée exercée par l’air sur les substances qu’il entoure.
La pression habituellement exercée par l’air libre est appelé pression atmosphérique.
A une altitude donnée cette pression ne varie que faiblement.
Cependant dans un récipient fermé on peut facilement modifiée la pression de l’air.
Si l’on diminue la pression de l’air l’ébullition d’une eau pure se déroule-t-elle d’une manière différente ?
Si les mesures de température réalisées dans le premier paragraphe sont faites à nouveau avec une pression plus faible on obtient toujours une ébullition qui se déroule à température constante mais avec une température inférieure à 100°C.
Sous une pression plus faible que la pression atmosphérique normale l’eau pure bout à une température constante inférieure à 100°C.
3) Ébullition de l’eau sous pure forte pression
La pression ayant une influence sur la température d’ébullition de l’eau pure on peut se demander ce qu’il se produit lorsque l’eau pure bout sous une pression supérieure à celle de la pression atmosphérique normale ?
La température d’ébullition reste constante mais cette fois elle prend une valeur supérieure à 100 °C.
Sous une pression plus élevée que la pression atmosphérique normale, l’eau pure bout à une température constante supérieure à 100°C.
4) Ébullition de l’eau salée
Les mesures réalisées dans les paragraphes précédents sont faites une nouvelle fois lorsqu’on provoque l’ébullition d’eau salée.
On obtient les résultats suivants :
| Temps (min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Température (°C) | 20 | 25 | 40 | 55 | 70 | 85 | 95 | 102 | 104 | 106 | 108 | 110 |
Ces résultats permettent de tracer la courbe suivante :
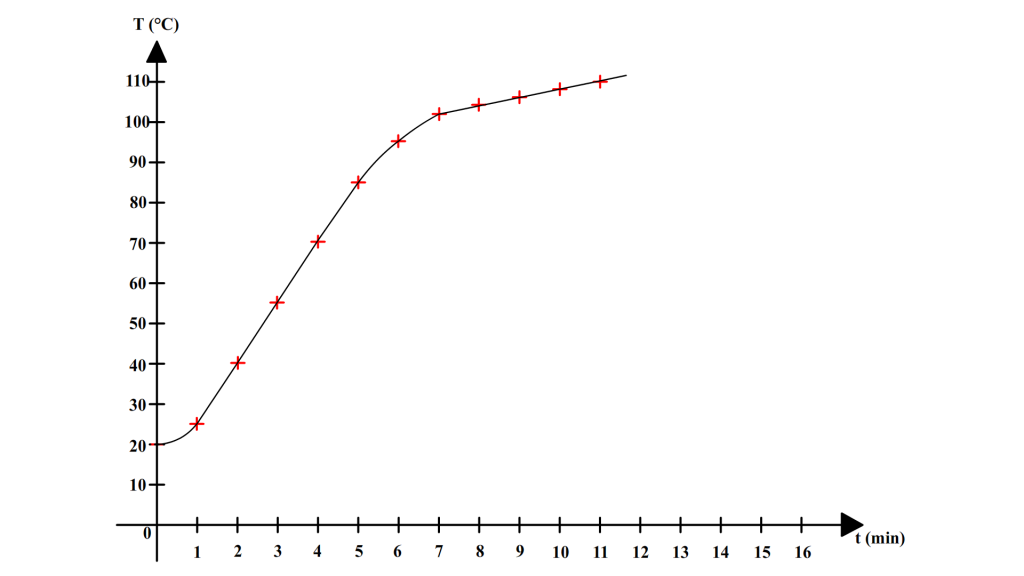
On remarque cette fois que l’eau ne présente pas de température d’ébullition constante. La température continue d’augmenter au cours de l’ébullition.
Un mélange ne possède pas de température d’ébullition constante : sa température augmente pendant l’ébullition.

L’eau salée bouille à 110 mais pour une concentration de combien ?
Je n’ai pas trouvé la concentration pour 110°C, mais il faudrait vraiment ajouter beaucoup de sel pour que la température d’ébullition de l’eau salée s’élève de quelques degrés.
Si l’on ajoute 70 grammes de sel dans 1 litre d’eau bouillante, la température d’ébullition de l’eau ne s’élèvera que de 1.5°C. Et pour 140 grammes de sel dans 1 litre d’eau, la température d’ébullition s’élèvera de 4°C. L’élévation de température n’est pas donc pas linéaire !
Si l’on met une pincée de 10 grammes de gros sel dans l’eau des pâtes pour 1 litre d’eau, le sel ne représente qu’une proportion de 1%. L’augmentation du point d’ébullition de moins de 0,2°C.
La pression atmosphérique peut également changer la température d’ébullition, par exemple s’il l’on est en montagne, à 2000 mètres, l’eau entrera en ébullition à dès 70°C.
« …La température continue d’augmenter au cours de l’ébullition… »
au cours de l’ébullition, l’eau s’évapore (mais pas le sel, augmentant ainsi sa concentration), ce pourquoi la courbe continue à croitre.