1) La composition de la pile au sulfate de cuivre
La pile au sulfate de cuivre est un exemple de pile électrochimique.
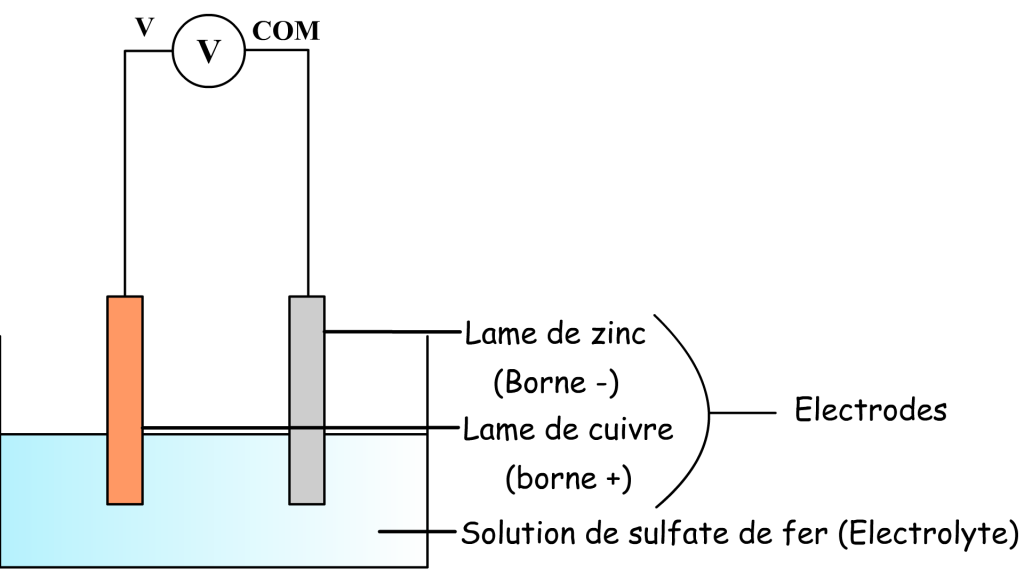
Elle est constituée d’une plaque de cuivre et d’une plaque de zinc qui jouent le rôle d’électrodes et qui correspondent aussi à ses deux bornes.
Ces deux électrodes baignent dans une solution ionique de sulfate de cuivre: on dit que cette solution est un électrolyte..
2) La tension de la pile au sulfate de cuivre et le signe de ses bornes
En reliant un multimètre en mode voltmètre aux bornes de la pile on peut mesurer une tension de l’ordre de 1 V.
Cette tension n’est positive que lorsque la borne com du multimètre est reliée au zinc et la borne de tension est reliée au cuivre.
D’après les règles de branchement d’un multimètre on peut en déduire que:
- Le zinc correspond à la borne négative.
- Le cuivre correspond à la borne positive
Schéma de la pile au sulfate de cuivre lors d’une mesure de tension

Les deux lames sont dans :
une solution de sulfate de Fer ou de sulfate de cuivre ?
Plus haut vous avez parlé de sulfate de Cuivre.
Merci à vous