1) Formation des ions à partir des atomes
Les atomes sont constitués d’électrons en mouvement autour d’un noyau. Lors de certains phénomènes (transformations chimiques, frottements mécaniques, exposition à des rayonnements) l’atome peut perdre un ou plusieurs électrons.
La perte d’électrons correspond également à une perte de charges négatives qui conduit à la formation d’un composé électriquement chargé: il s’agit d’un ions. Les électrons perdus par un atome ne peuvent subsister librement très longtemps et sont rapidement captés par un autre atome qui gagne des charges négatives et perd également sa neutralité électrique se transformant aussi en ion.
Un ion peut donc se former à partir d’un atome qui gagne ou perd un ou plusieurs électrons.
Remarques
- De tels ions qui se forment à partir d’un seul atome sont dits monoatomiques.
- Le nombre d’électrons autour d’un noyau peut changer mais le noyau n’est lui jamais modifié et conserve son nombre de charges positives initial.
2) Formation d’un cation
Un cation étant un ion positif il se forme à partir d’un atome qui perd des électrons.
En effet, après une perte d’électrons, les charges négatives deviennent moins nombreuses que les charges positives.
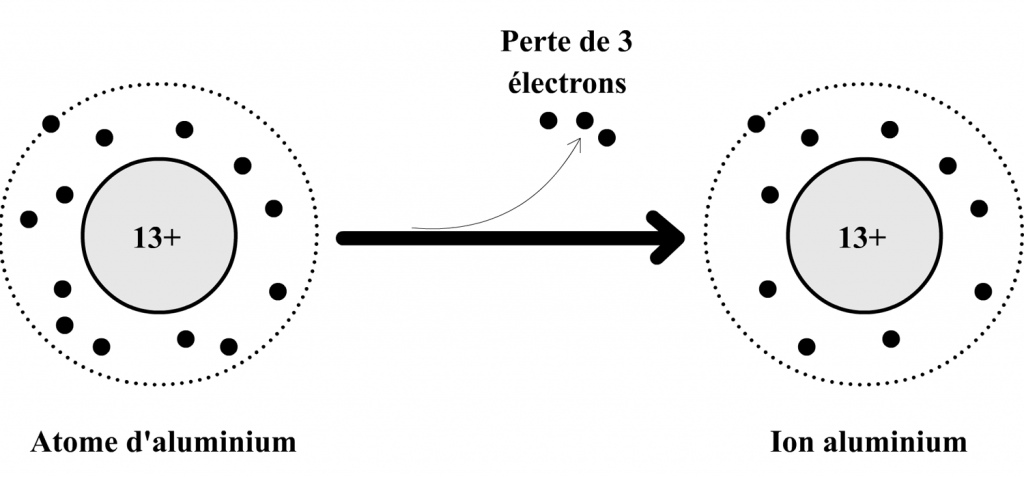
Exemple de la formation de l’ion aluminium
L’atome d’aluminium est composé :
- de 13 électrons qui portent au total 13 charges négatives.
- de 13 charges positives dans son noyau.
Cet atome peut perdre 3 électrons pour se transformer en ion aluminium qui est alors composé :
- de 13 – 3 = 10 électrons qui portent au total 10 charges négatives.
- de 13 charges positives dans son noyau ( le noyau n’est pas affecté par la perte des électrons)
Si l’on compare les charges positives et négatives on remarque que l’ion aluminium possède 3 charges positives en excès par rapport aux charges négatives (13 charges + et 10 charges -).
Cette charge en excès (aussi appelée charge excédentaire) est notée en exposant (en haut à droite) dans la formule de l’ion aluminium : Al3+ .
Schéma de transformation de l’atome d’aluminium en ion aluminium
Remarque
La formule d’un ion se forme toujours d’une manière analogue. On utilise le symbole de l’atome à partir duquel l’ion se forme puis on lui ajoute en exposant le nombre et le signe des charges en excès obtenu en comparant le nombre de charges positives et le nombre de charges négatives.
3) Formation d’un anion
Un anion étant un ion négatif il se forme à partir d’un atome qui gagne des électrons.
En effet, après un gain d’électrons, les charges négatives deviennent plus nombreuses que les charges positives.
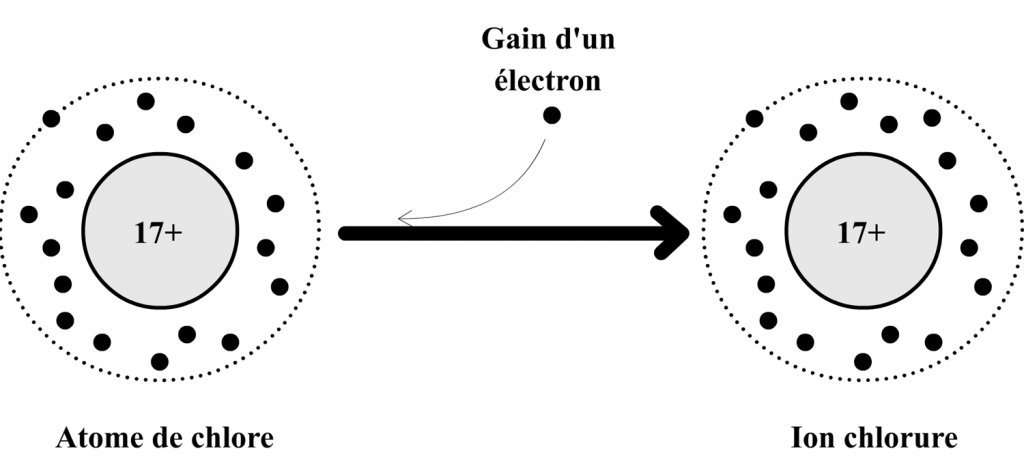
Exemple de la formation de l’ion Chlorure
L’atome de chlore est composé :
- de 17 électrons qui portent au total 17 charges négatives.
- de 17 charges positives dans son noyau.
Cet atome peut gagner un électron pour se transformer en ion chlorure qui est alors composé :
- de 17 + 1 = 18 électrons qui portent au total 18 charges négatives.
- de 17 charges positives dans son noyau.
Si l’on compare les charges positives et négatives, on remarque que l’ion chlorure possède une charges négative en excès par rapport aux charges positives (17 charges + et 18 charges -).
La formule de l’ion chlorure est donc : Cl– .
Schéma de transformation de l’atome de chlore en ion chlorure
4) Formule des principaux ions
Voici la formule chimique des principaux ions qui sont à connaître en classe de 3eme :
| Ion sodium | Ion cuivre | Ion chlorure | Ion fer (II) | Ion fer (III) |
|---|---|---|---|---|
| Na+ | Cu2+ | Cl– | Fe2+ | Fe3+ |
5) Les ions polyatomiques
Les ions peuvent également se former à partir d’ensembles de plusieurs atomes qui perdent ou gagnent un ou plusieurs électrons. Ces ions sont alors appelés des ions polyatomique ( poly = plusieurs et atomique dérive d’atome).
Exemples d’ions polyatomique
- L’ion sulfate de formule SO42-
- L’ion carbonate de formule CO32-

Qu’observerais-tu ?
merci je comprends enfin mes cours de physique ! <3
J’avais perdu mes cours, j’laisse jamais de commentaires mais la vous m’avez bien aidé, vous gérez comme jamais 😉
Gros merci
Comment on sait combien un atome peut perdre ou gagner d’électrons?
la formule des principaux ions au collège Na+, Cl-, Cu++, Fe++, Fe +++
à savoir par cœur !!!
Na + perd 1 électron (soduim)
cl – gagne 1 électron (chlore) …..
Bonjour, déjà très bon site et merci
Mais concernant les polyatomiques j’ai encore du mal à comprendre.
Si vous pouviez me donner de plus amples explications ce serait géniale.
Et encore merci
j’ai enfin compris merci beaucoup sa ma aider
Merci ! On dirait les cours de ma professeur !
J’adore, c’est vraiment bien résumé, vive les passionnés de la Science!
Les ions cherche a être stable cest pour ça qu’ils ont 2l ou 8 electrons externes
l’element chimique est stable lorsque la derniere couche de la structure electronique de son atome est saturée
J’ai un problème : il ont demandé de dessiner un atome de magnésium qui possède 12 charges positives (leur charge électrique) Cet atome porte t-il une charge électrique totale ? Expliquer. S’est ça ma question s’il vous plait répondre a ma question merci
Definitions:
Un nucleïde est l’ensemble des atomes dont les noyau possède le même couple
Bonjour,
J’ai un devoirs à faire en Physique Chimie mais il y a une question qui est la suivante : Comment l’ion Cu2+ s’est-il formé à partir de l’atome de cuivre ? mais je ne comprend pas comment je dois répondre, Donc si vous pouvez m’aider cela serais bien ! Merci d’avance !!!
Bonne journée,
Merci
Grâce à vous je vais pouvoir expliquer à ma fille qui est en 3ème