Le but est d’étudier la transformation chimique qui se produit lorsque de la poudre de zinc métallique est en contact avec une solution de sulfate de cuivre.
Réalisation: on place de la poudre de zinc dans un tube à essais puis l’on agite et on observe le résultat.
Observations:
- En touchant le tube à essai on peut se rendre compte que celui-ci est anormalement chaud. Une mesure de température à l’aide d’un thermomètre permet de confirmer que la température de la solution est nettement plus élevée après le mélange qu’avant.
- La solution de sulfate de cuivre initialement bleue devient quasiment incolore.
- La poudre de zinc change de couleur: elle prend par endroit une couleur orangée qui rappelle celle du cuivre orangé
Test complémentaire:
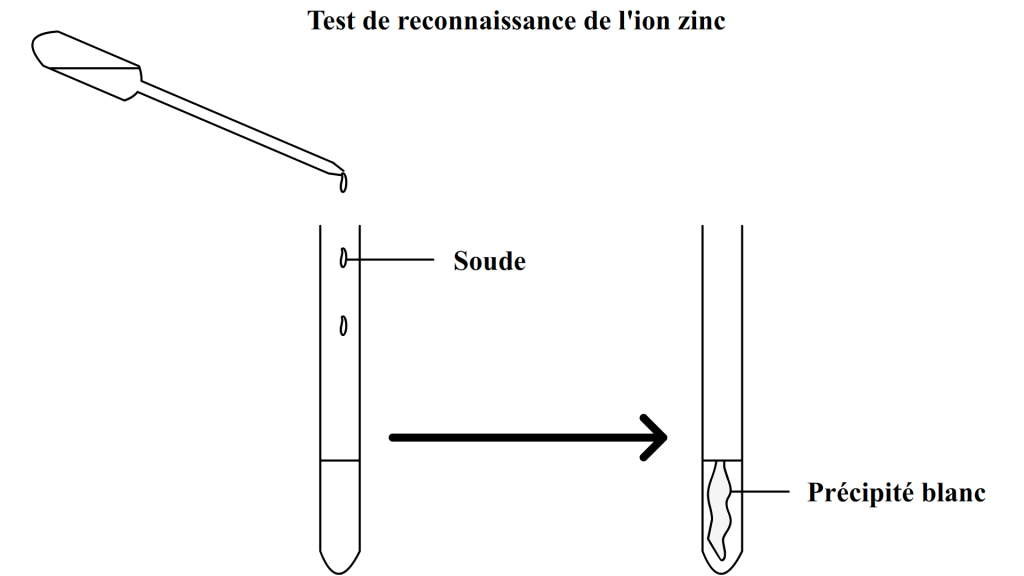
On effectue un test de reconnaissance d’ion sur la solution obtenue.
On ajoute de la soude et on obtient un précipité qui n’est pas bleu mais blanc.
Ce test permet de déduire que les ions cuivres ont bien disparus de la solution aqueuse et qu’ils ont laissé la place aux ions zinc qui forment un précipité blanc avec la soude.
Interprétation et synthèse des observations et du test:
Il se produit bien une transformation chimique car des composés chimiques apparaissent et d’autres apparaissent.
La disparition de la couleur bleu et l’absence de précipité bleu lors du test indique que les ions cuivres disparaissent tandis que du cuivre métallique se forme sur la poudre de zinc restante.
Le test complémentaire indique que des ions zinc sont apparus et ceux-ci ne peuvent se former qu’à partir des atomes de zinc métalliques.
Les ions sulfate ne subissent aucune modification particulière et restent en solution après la transformation chimique où ils forment avec les ions zinc une solution de sulfate de zinc.
Ces transformations peuvent être résumées par la réaction chimique suivante :
Zinc + sulfate de cuivre → cuivre + sulfate de zinc
Cette transformation chimique s’accompagne également d’un dégagement de chaleur.
L’énergie chimique présente dans les réactifs est donc en partie libérée, en partie, sous forme d’énergie thermique.


MERCI BEAUCOUP !!
J’avais un DM de Physique-Chimie et ce cour ma beaucoup aidé.
Je vous direz bientôt la note que j’ai eu 😉
alors t as eu combien? anonyme si je peux
J’ai eu 11 sur 20 🙂
Sans cet exercice de transformation chimique réussi je me serais tapé un 6 sur 20!