Changements intervenant au niveau moléculaire lors de la compression d’un gaz enfermé dans une seringue (les molécules sont représentées par des ronds)
Interprétation moléculaire de la compression

Observations :
- Le nombre de molécules ne change pas
- La taille et la forme des molécules ne changent pas.
- Il y a moins d’espace entre les molécules
Conclusion : Lors d’une compression le volume d’un gaz diminue car l’espace vide entre les molécules se réduit.
Changements intervenant au niveau moléculaire lors de la détente d’un gaz enfermé dans une seringue.
Interprétation moléculaire de la détente

Observations :
- Le nombre de molécules ne change pas
- La taille et la forme des molécules ne change pas.
- Il y a plus d’espace entre les molécules.
Conclusion : Lors d’une compression le volume d’un gaz diminue car l’espace vide entre les molécules augmente.
Lors d’une compression ou d’une détente l’espace qui sépare les molécules est modifié, mais pas leur nombre, ni leur taille.
Remarque
L’état solide et l’état liquide sont des états compacts où les molécules sont en contacts. L’espace qui les sépare ne peut être ni réduit ni augmenté.
Les corps à l’état solide et liquide ne sont donc ni compressibles ni expansibles.
2) Conservation de la masse totale lors d’une dissolution
Rappel
Lors d’une dissolution, la masse totale du soluté et du solvant est égale à la masse de la solution aqueuse obtenue.
(Exemple si on dissout 30 g de sucre dans 100 g d’eau on obtient une solution aqueuse de masse m = 30 + 100 = 130 g)
Exemple
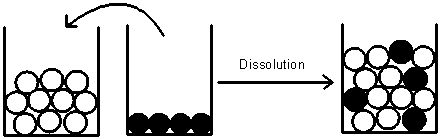
Dissolution de sucre dans de l’eau
(Les molécules d’eau sont représentées par des ronds blancs et celle de sucre par des ronds noirs)
Observation
Le nombre de molécules d’eau et de sucre est le même avant et après la dissolution.
Conclusion
La masse totale se conserve lors d’une dissolution car le nombre de chaque sorte de molécules ne change pas.
3) Conservation de la masse lors d’un changement d’état
Rappel
Lorsqu’un corps change d’état sa masse reste la même.
Exemple
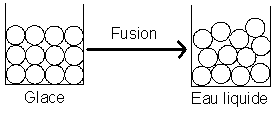
Fusion de la glace
(Les molécules d’eau sont représentées par des ronds blancs)
- Les molécules ne sont pas disposées de la même manière
- Le nombre, la taille et la forme des molécules d’eau ne change pas.
Conclusion
La masse ne change pas lors d’un changement d’état car le nombre de molécules ne change pas.